interacciones intermoleculares
Las fuerzas intermoleculares son las que ocurren en moléculas distintas. Hay cuatro fuerzas que destacan entre estas son:
Fuerzas de Dispersión de London
Son fuerzas intermoleculares débiles que surgen de fuerzas interactivas entre multipolos temporales en moléculas sin momento multipolo permanente. Las fuerzas de dispersión de London también son conocidas como fuerzas de dispersión, fuerzas de London o fuerzas dipolo-dipolo inducido. Las fuerzas de London pueden ser exhibidas por moléculas no polares debido a que la densidad electrónica se mueve alrededor de la molécula de una manera probabilística (ver teoría mecánico cuántica de las fuerzas de dispersión. Hay una gran probabilidad de que la densidad electrónica no esté distribuida por igual en una molécula apolar. Ejemplos de estas fuerzas son en las moléculas CO2 y CH4

Interacción ión-dipolo:
Esta interacción se da con la presencia de un átomo que presenta un desbalance electrónico (anión, si presenta más electrones que protones, o catión si presenta más protones que electrones) y presenta dos variaciones: cuando interactúa con una molécula apolar (ión-dipolo inducido) o con una molécula polar (ión-dipolo). En el primer caso, al acercarse el ión a una molécula apolar, el dipolo momentáneo que se produce naturalmente en esta, se establece de manera fija, como si fuera una interacción ión-dipolo normal. El segundo caso ocurre al interactuar un ión con una molécula polar (la cual presenta un dipolo constante).
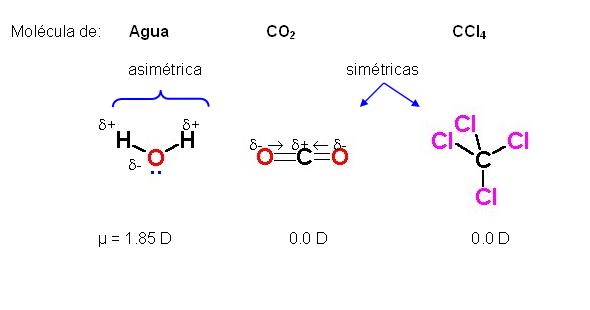
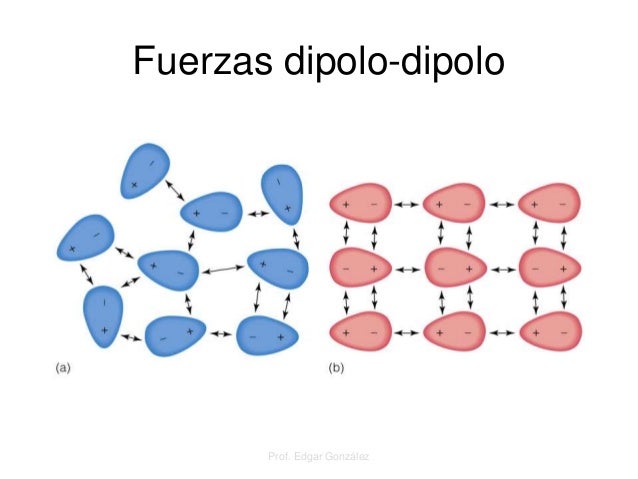
Interacción dipolo-dipolo:
Al igual que la anterior, la interacción dipolo-dipolo puede darse entre dos moléculas polares o entre una molécula polar con otra apolar, denominándose este último tipo de interacción, dipolo-dipolo inducido. Este tipo de interacción es, por lo general, más débil que la interacción ión-dipolo, debido a que en este último, una de las sustancias involucradas presenta una carga "total", mientras que en la interacción dipolo-dipolo, solo se enfrentan dos diferenciales de carga (o cargas "parciales"), lo que hace disminuir su fuerza. Ejemplos de el es ácido clorhídrico y el cloruro de bromo.
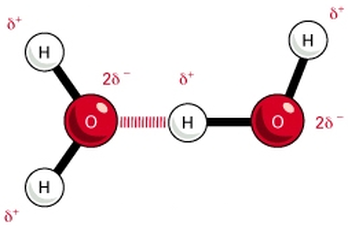
Puente de Hidrógeno
La interacción puente de Hidrógeno es un caso especial de una interacción dipolo-dipolo, que se produce cuando un átomo de Hidrógeno, que se encuentra enlazado a un átomo de N, O o F, interacciones con un átomo de N, O o F de otra molécula. Debido a sus características, el puente de Hidrógeno es la interacción intermolecular más fuerte, lo que provoca que las sustancias que poseen esta interacción como la principal, presenten un estado de agregación mayor (comparado con sustancias con pesos similares).un ejemplo de ello son los lípidos y las proteínas.
Comentarios
Publicar un comentario