interacciones intramoleculares
Se clasifican en tres:
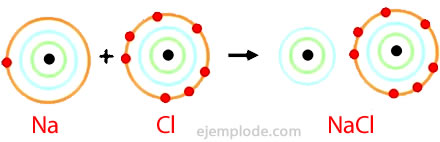
Enlace Iónico: En los enlaces químicos, los átomos pueden transferir o
compartir sus electrones de valencia. En el caso extremo en que uno o más
átomos pierden electrones, y otros átomos los ganan con el fin de producir una
configuración de electrones de gas noble, el enlace se denomina enlace iónico.
Enlace covalente: Los enlaces covalentes se definen como la unión que se
produce entre 2 átomos por la compartición de 2 o más electrones de su capa
externa con objeto de formar una molécula estable.
Este tipo de enlace a su vez se divide en dos:
Un enlace covalente polar es un enlace covalente entre dos átomos donde los electrones que forman el enlace están desigualmente distribuidos. Esto provoca que la molécula tenga un ligero momento dipolar eléctrico en el que un extremo es ligeramente positivo y el otro ligeramente negativo. un ejemplo de el es el Yoduro de hidrógeno (HI)

Enlace covalente no polar: Un enlace covalente puro o enlace covalente no polar, existe
cuando los átomos comparten equitativamente a los electrones de enlace. Si los
átomos enlazados son no metales idénticos los electrones son compartidos por
igual, por lo que se produce un enlace covalente puro, también llamado enlace
covalente no polar.un ejemplo de este enlace son el Cl2, H2.

Enlace metálico: El enlace metálico ocurre entre dos átomos de metales. En
este enlace todos los átomos envueltos pierden electrones de sus capas mas
externas, que se trasladan más o menos libremente entre ellos, formando una
nube electrónica (también conocida como mar de electrones). Un ejemplo son enlace entre las moleculas de oro(Au), plata (Ag).

Comentarios
Publicar un comentario